Introduction
L’article publié dans The Lancet Infectious Diseases souligne l’absence de traitements approuvés pour le syndrome post-COVID-19, plus communément appelé long COVID. Cette affection chronique, qui touche potentiellement des dizaines de millions de personnes, résulte d’une infection par le SARS-CoV-2 et se caractérise par des symptômes persistants et invalidants.
Un corpus croissant de recherches indique que le virus peut persister dans l’organisme plusieurs mois, voire plusieurs années, après l’infection aiguë chez certains individus. Cette persistance virale pourrait être un facteur majeur dans le développement et le maintien des symptômes du long COVID.
Face à cette hypothèse, il devient essentiel de mener des essais cliniques ciblant les réservoirs persistants de SARS-CoV-2. Plusieurs essais évaluant l’efficacité d’antiviraux et d’anticorps monoclonaux sont en cours, mais leur conception doit tenir compte de nombreux paramètres, notamment :
- Les mécanismes encore mal compris de la persistance virale.
- Le choix des participants et des traitements adaptés.
- La durée du traitement.
- La standardisation des biomarqueurs liés aux réservoirs viraux.
- Les critères d’évaluation des résultats et les stratégies thérapeutiques combinées.
L’article s’appuie sur les enseignements tirés d’études sur d’autres infections persistantes, notamment le VIH et l’hépatite C, ainsi que sur la médecine de précision en oncologie, pour proposer des orientations pertinentes dans la conception et l’analyse des essais cliniques consacrés au long COVID.
Le réservoir du SARS-CoV-2
Initialement, la communauté scientifique pensait que l’infection par le SARS-CoV-2 était transitoire chez les individus immunocompétents. Cependant, de nombreuses études ont désormais démontré l’existence d’un réservoir viral chez certains patients atteints de long COVID.
Preuves de la persistance virale
Des traces du virus – sous forme d’ARN simple brin, d’ARN double brin ou de protéines virales – ont été détectées bien après la phase aiguë de l’infection dans divers tissus et types cellulaires :
- Tissus intestinaux : plusieurs études ont retrouvé des fragments du SARS-CoV-2 dans l’intestin des patients atteints de long COVID, parfois jusqu’à plusieurs mois après l’infection initiale.
- Cellules hôtes spécifiques : la persistance virale a également été mise en évidence dans des cellules sanguines comme les plaquettes et les mégacaryocytes.
- Protéines virales dans le plasma : certaines recherches ont révélé la présence de protéines du virus dans le sang jusqu’à 14 mois après l’infection, ce qui suggère que du matériel viral est continuellement produit par des réservoirs tissulaires et relâché dans la circulation sanguine.
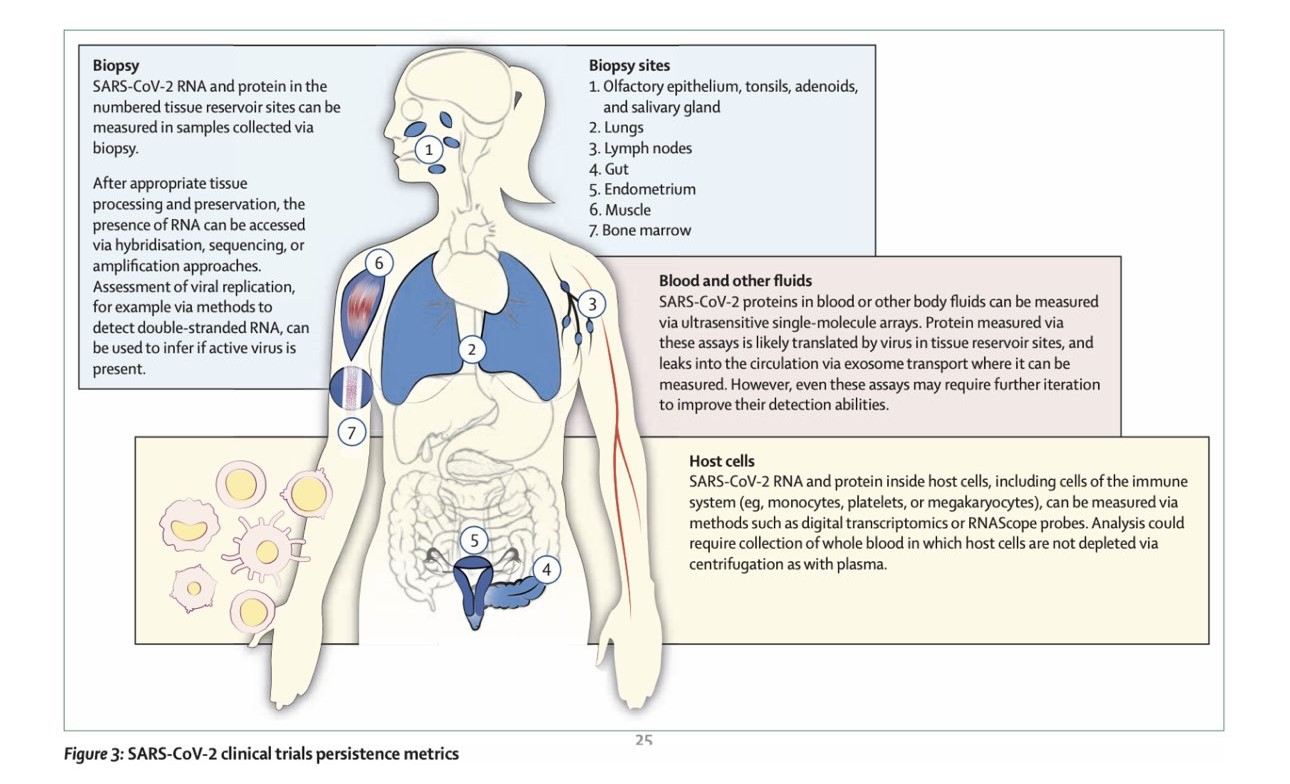
Lien entre la persistance virale et le long COVID
Bien que le SARS-CoV-2 puisse persister même chez des individus ne présentant pas de symptômes de long COVID, plusieurs éléments établissent une corrélation entre la présence du virus et la maladie :
- Une étude du programme RECOVER des National Institutes of Health (NIH) a montré que les patients souffrant de symptômes post-aigus affectant les systèmes cardiovasculaire, neurologique et musculo-squelettique avaient deux fois plus de chances d’avoir des protéines du SARS-CoV-2 détectables dans leur sang.
- La persistance du virus pourrait être un facteur de dysfonctionnement immunitaire, maintenant une inflammation chronique et perturbant la réponse immunitaire contre l’infection.
Hypothèses sur la persistance du virus
Le réservoir viral pourrait être maintenu par plusieurs mécanismes :
- Présence d’ARN viral sans réplication active : certains fragments d’ARN pourraient rester stockés dans certaines cellules sans être traduits en protéines ou produire de nouveaux virions.
- Traduction d’ARN viral sans production de nouveaux virions : la présence continue de protéines virales pourrait suffire à stimuler une réponse immunitaire persistante.
- Réactivation périodique du virus : le virus pourrait se répliquer à bas bruit et réinfecter d’autres cellules, maintenant un cycle d’infection à faible intensité.
Ces mécanismes rappellent ceux observés dans d’autres infections persistantes, comme le VIH ou le virus Ebola, où des réservoirs viraux sont maintenus dans des sites immuno-privilégiés comme le cerveau ou les testicules.
Établissement et maintien du réservoir du SARS-CoV-2
Origine du réservoir viral
L’établissement du réservoir viral commence dès la phase aiguë de l’infection par le SARS-CoV-2. Plusieurs facteurs, tant liés au virus qu’à l’hôte, influencent la persistance du virus dans l’organisme.
Des études ont montré que les patients ayant une charge virale plus élevée lors de l’infection initiale sont plus susceptibles de présenter des signes de persistance virale à long terme. De plus :
- Une plus longue durée d’excrétion virale ou un pic de charge virale plus élevé pendant la phase aiguë sont associés à un risque accru de développer un long COVID.
- Une étude post-mortem a détecté la présence de fragments d’ARN du SARS-CoV-2 et de protéines virales dans plusieurs dizaines de tissus, y compris le cerveau et les nerfs optiques, jusqu’à 230 jours après le début de la maladie.
- Cette dissémination virale évoque des phénomènes similaires à ceux observés dans le syndrome post-Ebola, où des réservoirs viraux ont été identifiés dans des sites immuno-privilégiés (testicules, yeux, cerveau) longtemps après la guérison clinique.
Facteurs favorisant la persistance du virus
La persistance du SARS-CoV-2 pourrait être liée à une dysfonction du système immunitaire. Par exemple :
- Une production insuffisante d’anticorps neutralisants a été corrélée à la présence d’un réservoir viral plus durable.
- Certaines personnes ayant eu une forme légère de COVID-19 développent des symptômes tardifs de long COVID, suggérant que l’établissement du réservoir pourrait être favorisé par une réponse immunitaire défaillante dès la phase aiguë.
- Des études suggèrent que des traitements antiviraux précoces ou la vaccination pourraient réduire la charge virale initiale et limiter la formation de réservoirs persistants.
Mécanismes de maintien du réservoir viral
Une fois le réservoir établi, plusieurs processus biologiques pourraient expliquer sa persistance dans l’organisme :
- Persistance de l’ARN viral sans production de nouveaux virions :
- Comme d’autres virus à ARN, le SARS-CoV-2 pourrait rester sous forme de matériel génétique non traduit, échappant ainsi aux défenses immunitaires.
- Traduction continue de protéines virales sans réplication active :
- Des protéines virales peuvent être produites par le réservoir tissulaire et déclencher une réponse immunitaire persistante, sans qu’il y ait pour autant réplication virale.
- Cela expliquerait la présence de protéines virales détectées dans le plasma des patients atteints de long COVID.
- Réactivation périodique et réplication à bas bruit :
- Certaines études ont mis en évidence la présence d’ARN double brin et de transcrits subgénomiques, suggérant que le virus pourrait se répliquer à faible intensité dans certains tissus.
- Cette hypothèse pourrait expliquer les fluctuations des symptômes rapportées par les patients atteints de long COVID.
Perspectives pour les futures recherches
- Il est essentiel de déterminer quel mécanisme de persistance prédomine afin de concevoir des traitements ciblés et adaptés.
- La surveillance des biomarqueurs associés à la persistance virale permettra de mieux comprendre les dynamiques du réservoir et d’optimiser les essais cliniques visant à l’éliminer.
Cibler directement le virus
Antiviraux
Les antiviraux constituent une approche évidente pour réduire la charge virale et potentiellement éliminer le réservoir. Ces molécules ne détruisent pas directement le virus, mais empêchent sa réplication en ciblant des enzymes clés de son cycle de vie, comme :
- Les inhibiteurs de la protéase virale (nirmatrelvir–ritonavir, ensitrelvir).
- Les inhibiteurs de l’ARN polymérase dépendante de l’ARN (remdesivir).
Certains de ces antiviraux sont actuellement testés dans plusieurs essais cliniques ciblant le long COVID (ex. NCT05595369, NCT05668091, NCT05911906).
Limites et défis des antiviraux :
- La capacité des antiviraux à pénétrer les tissus où le réservoir est localisé (intestin, ganglions lymphatiques, SNC) reste incertaine.
- Les études montrent qu’un traitement trop court (ex. 15 jours de nirmatrelvir–ritonavir) ne produit pas d’amélioration significative des symptômes du long COVID, suggérant que des traitements plus longs sont nécessaires.
Anticorps monoclonaux (mAbs)
Les anticorps monoclonaux offrent une double action :
- Neutralisation directe du virus encore en circulation.
- Élimination des cellules infectées via des mécanismes immunitaires comme la cytotoxicité dépendante des anticorps.
Les anticorps monoclonaux sont actuellement testés dans des essais pour la prévention et le traitement du COVID-19, mais leur efficacité contre le long COVID reste à confirmer. Un défi majeur est que les variants émergents du SARS-CoV-2 peuvent échapper aux anticorps développés pour des souches plus anciennes.
Thérapies innovantes : oligonucléotides antisens et CRISPR
Des technologies émergentes comme les oligonucléotides antisens et les approches basées sur CRISPR pourraient permettre de cibler et détruire spécifiquement l’ARN viral, même si celui-ci ne se réplique pas activement. Cependant, ces approches nécessitent des recherches supplémentaires, notamment pour s’assurer qu’elles atteignent efficacement les tissus réservoirs.
Renforcer la réponse immunitaire de l’hôte
Puisque le SARS-CoV-2 persistant semble échapper au système immunitaire, plusieurs stratégies visent à améliorer l’élimination du virus par l’organisme :
Thérapies basées sur les cytokines
Des molécules comme les superagonistes d’interleukines (ex. IL-15) pourraient stimuler la réponse des cellules T et des cellules NK (natural killer) pour mieux cibler et éliminer les cellules réservoirs. Ces approches sont déjà explorées dans le traitement du VIH.
Limites :
- Une stimulation excessive du système immunitaire pourrait provoquer une aggravation temporaire des symptômes, un phénomène déjà observé dans certaines maladies inflammatoires.
Inhibiteurs des points de contrôle immunitaires (PD-1/PD-L1)
Les cellules T spécifiques du SARS-CoV-2 montrent parfois des signes d’épuisement chez les patients atteints de long COVID. Les inhibiteurs des points de contrôle immunitaires, utilisés en oncologie et dans la recherche sur le VIH, pourraient restaurer leur fonction et aider à éliminer le virus.
Défis :
- L’effet exact de ces traitements sur le long COVID reste à déterminer.
- Ces médicaments peuvent induire des réactions auto-immunes chez certains patients.
Vaccination thérapeutique
La vaccination contre le COVID-19 a montré des effets variés sur le long COVID : certains patients ont rapporté une amélioration de leurs symptômes, tandis que d’autres ont constaté une aggravation. L’hypothèse est que les vaccins actuels (ciblant la protéine Spike) pourraient réactiver la réponse immunitaire contre le virus persistant.
Les futures générations de vaccins pourraient inclure des cibles antigéniques plus larges (ex. nucléocapside, protéines accessoires) pour mieux stimuler l’élimination des cellules réservoirs.
Autres stratégies et perspectives
L’article souligne la nécessité d’une approche combinée pour traiter efficacement le long COVID :
- Combinaison antiviraux + immunothérapie pour à la fois bloquer la réplication du virus et renforcer l’immunité.
- Meilleure compréhension des biomarqueurs de persistance virale pour identifier les patients qui bénéficieraient le plus de ces traitements.
Des essais cliniques sont en cours pour évaluer l’efficacité de ces différentes stratégies, mais des défis méthodologiques persistent.
Considérations clés pour les essais cliniques ciblant le réservoir viral
Le développement d’essais cliniques visant à cibler la persistance du SARS-CoV-2 dans le long COVID doit prendre en compte plusieurs facteurs cruciaux pour garantir leur fiabilité et leur efficacité.
Mesures de la persistance virale
L’évaluation de la présence du virus dans l’organisme est un défi majeur. Bien que des études post-mortem aient confirmé la persistance du SARS-CoV-2 dans plusieurs tissus, il est nécessaire de développer des biomarqueurs non invasifs pour identifier cette persistance chez les patients vivants.
- Biopsies tissulaires : Elles constituent la méthode la plus fiable pour détecter le virus dans les tissus (intestin, ganglions lymphatiques, poumons, etc.), mais sont invasives et difficiles à standardiser.
- Détection d’antigènes viraux dans le sang : Certaines études ont montré que des protéines du virus peuvent être détectées dans le plasma des patients atteints de long COVID. Cependant, cette détection est variable et pourrait dépendre de la dynamique de libération des protéines virales dans la circulation.
- Présence de l’ARN viral dans les cellules immunitaires : L’ARN du SARS-CoV-2 a été retrouvé dans certaines cellules comme les monocytes et les plaquettes, suggérant un rôle potentiel de ces cellules dans la persistance du virus.
- Tests ultrasensibles (Simoa, CRISPR-based detection) : Ces technologies émergentes pourraient améliorer la capacité à détecter des traces virales dans le sang, la salive ou les selles.
Le développement et la validation de ces tests sont essentiels pour permettre des essais cliniques mieux ciblés et plus inclusifs.
Sélection des participants
Un défi majeur des essais cliniques sur le long COVID est la grande hétérogénéité des patients. Tous les patients atteints de long COVID ne présentent pas nécessairement une persistance virale, et inclure des individus sans réservoir viral pourrait fausser les résultats des études.
Deux approches sont possibles :
- Sélectionner uniquement les patients avec une persistance virale prouvée : Cela nécessiterait des tests préalables pour identifier la présence d’ARN viral ou de protéines du SARS-CoV-2 avant d’inclure un patient dans l’essai.
- Inclure tous les patients répondant aux critères de long COVID, puis stratifier les résultats en fonction de la persistance virale : Cette approche permettrait une analyse post-hoc pour déterminer si les patients ayant des marqueurs de persistance bénéficient davantage des traitements.
Certains essais (comme NCT05747534, qui teste le larazotide) exigent déjà la présence d’un biomarqueur viral pour l’inclusion des participants.
Durée et moment du traitement
La durée optimale du traitement pour éradiquer un réservoir viral est inconnue. La plupart des essais en cours testent des durées courtes (10-15 jours), mais des traitements plus longs pourraient être nécessaires, comme c’est le cas pour d’autres infections virales persistantes :
- Hépatite C : les antiviraux doivent être administrés pendant 8 à 12 semaines pour éradiquer complètement le virus.
- FIV (coronavirus félin) : des traitements de 12 semaines ont été nécessaires pour éliminer le virus.
Il est probable que des traitements de plusieurs mois soient nécessaires pour un effet significatif contre le réservoir du SARS-CoV-2.
Un autre facteur important est le timing de l’intervention :
- Une intervention très précoce après l’infection pourrait empêcher la formation du réservoir.
- Une intervention plus tardive, après l’établissement du long COVID, nécessiterait une approche combinée (ex. antiviraux + immunomodulateurs).
Pénétration tissulaire des médicaments
Le SARS-CoV-2 semble persister dans des tissus difficiles d’accès pour certains médicaments, comme :
- L’intestin
- Les ganglions lymphatiques
- Le système nerveux central (SNC)
Les essais devront prendre en compte la capacité des traitements à atteindre ces sites réservoirs :
- Certains antiviraux actuels n’atteignent pas bien le SNC, ce qui pourrait limiter leur efficacité sur les symptômes neurologiques du long COVID.
- Des stratégies innovantes, comme l’utilisation d’anticorps IgA administrés par voie intranasale, pourraient être nécessaires pour cibler les réservoirs mucosaux.
Gestion des réinfections pendant l’étude
Dans le contexte actuel où le SARS-CoV-2 circule toujours largement, la réinfection des participants pendant les essais cliniques représente un biais majeur :
- Une nouvelle infection pourrait affecter la réponse au traitement, compliquant l’interprétation des résultats.
- Des tests réguliers pourraient être nécessaires pour identifier les patients réinfectés et adapter les analyses en conséquence.
Les chercheurs proposent d’ajouter des analyses intermédiaires précoces (ex. à 30 jours) pour garantir que des données significatives puissent être obtenues avant une éventuelle réinfection.
Essais combinant plusieurs approches thérapeutiques
Jusqu’à présent, la plupart des essais sur le long COVID testent un seul traitement à la fois. Cependant, si la persistance virale est multifactorielle, une combinaison de traitements pourrait être plus efficace :
- Antiviraux + anticorps monoclonaux : pour bloquer la réplication virale et éliminer les cellules infectées.
- Antiviraux + immunomodulateurs : pour renforcer la réponse immunitaire et restaurer la capacité du corps à éliminer le virus.
Cette approche est déjà testée dans la recherche sur le VIH, où des combinaisons thérapeutiques sont utilisées pour réduire le réservoir viral.
Blinding et effet placebo
Les essais cliniques sur le long COVID doivent intégrer des groupes placebo pour éviter les biais liés aux attentes des patients. L’effet placebo semble particulièrement élevé dans les études sur le long COVID.
Un problème potentiel est que certains médicaments ont des effets secondaires reconnaissables (ex. dysgueusie avec nirmatrelvir–ritonavir), ce qui peut compromettre le double aveugle.
Dans certains cas, il pourrait être nécessaire de concevoir des études sans placebo, mais en fixant des seuils d’efficacité élevés pour minimiser les biais.
Sécurité et tolérance des traitements
Bien que la plupart des médicaments testés dans les essais actuels soient déjà utilisés pour d’autres indications, leur tolérance dans le contexte du long COVID reste incertaine.
- Certains traitements, comme les inhibiteurs de points de contrôle immunitaires, peuvent provoquer des réactions auto-immunes.
- Des antiviraux comme les inhibiteurs de protéases (ex. ritonavir) peuvent interagir avec d’autres médicaments que prennent les patients atteints de long COVID.
- Les immunothérapies pourraient aggraver temporairement les symptômes avant d’induire une amélioration.
Il est donc essentiel de surveiller étroitement les effets secondaires dans ces essais.
Prévention du long COVID et implications industrielles
Alors que la majorité des essais cliniques se concentrent sur le traitement du long COVID après son apparition, il est tout aussi important d’explorer des stratégies de prévention. L’article souligne que réduire la persistance virale dès la phase aiguë pourrait empêcher la formation du réservoir du SARS-CoV-2 et ainsi prévenir le développement du long COVID.
Prévenir le long COVID dès l’infection initiale
Certaines interventions administrées précocement après l’infection pourraient réduire le risque de long COVID en limitant la charge virale et la persistance du virus.
1. Traitement antiviral précoce
Des études récentes ont montré que l’administration rapide d’antiviraux peut réduire le risque de long COVID :
- Le nirmatrelvir-ritonavir (Paxlovid) a démontré une réduction du risque de long COVID dans plusieurs études observationnelles.
- Le remdesivir et d’autres antiviraux pourraient également limiter la persistance virale lorsqu’ils sont administrés tôt.
- Le metformine (médicament antidiabétique) a montré un effet antiviral contre le SARS-CoV-2 et une réduction de 42 % du risque de long COVID dans un essai clinique.
Malgré ces résultats prometteurs, les essais cliniques actuels ont rarement intégré la persistance virale comme critère d’évaluation principal. L’article recommande donc d’inclure l’évaluation du réservoir viral comme un objectif clé dans les futurs essais sur les antiviraux administrés en phase aiguë.
2. Vaccination et réduction du risque de long COVID
La vaccination joue un rôle important dans la prévention du long COVID, bien que les mécanismes exacts restent encore incertains :
- Plusieurs études ont montré que les personnes vaccinées sont moins susceptibles de développer un long COVID après une infection.
- Les vaccins actuels ciblent principalement la protéine Spike, mais des vaccins de nouvelle génération intégrant d’autres cibles virales pourraient mieux stimuler l’élimination des cellules infectées et réduire la persistance virale.
Cependant, l’article souligne que l’effet des vaccins sur le long COVID n’est pas uniforme :
- Certains patients rapportent une amélioration des symptômes après la vaccination,
- Tandis que d’autres signalent une aggravation.
Ces différences pourraient être liées aux interactions entre le système immunitaire et le réservoir viral, ce qui justifie la nécessité de recherches supplémentaires.
3. Durée optimale du traitement en phase aiguë
Si une intervention précoce peut prévenir la persistance du SARS-CoV-2, la durée optimale du traitement reste à définir.
- Actuellement, la plupart des traitements antiviraux contre le COVID-19 sont limités à 5 jours en phase aiguë.
- Pour d’autres virus persistants (comme l’hépatite C), des traitements de 8 à 12 semaines sont nécessaires pour éradiquer complètement l’infection.
Des essais cliniques devraient donc tester des durées de traitement plus longues pour voir si elles permettent de prévenir la formation d’un réservoir viral et, par conséquent, du long COVID.
Enjeux industriels et financement des essais cliniques
Défi du financement des essais sur le long COVID
Un obstacle majeur au développement de traitements ciblant la persistance du SARS-CoV-2 est le manque d’engagement de l’industrie pharmaceutique. Contrairement aux antiviraux pour le VIH ou l’hépatite C, il n’existe pas encore de modèle économique clair pour les traitements du long COVID.
L’article met en évidence plusieurs problèmes :
- Risque financier pour les entreprises :
- Les essais cliniques sur le long COVID sont longs, coûteux et complexes.
- Les entreprises hésitent à investir sans certitude de succès ou de rentabilité.
- Absence de cadre réglementaire spécifique :
- Aucun traitement n’a encore reçu une autorisation officielle pour le long COVID, ce qui rend l’investissement plus risqué pour les laboratoires pharmaceutiques.
- Les agences réglementaires doivent donc définir des critères d’approbation clairs pour ces futurs traitements.
- Comparaison avec la recherche sur le VIH :
- Dans les années 1990, les traitements contre le VIH ont bénéficié d’un financement public massif pour accélérer les essais cliniques.
- Un effort similaire est nécessaire pour dé-risquer les investissements dans la recherche sur le long COVID.
Vers un modèle de collaboration public-privé
L’article recommande une approche combinée pour accélérer le développement de traitements :
- Création de partenariats entre les laboratoires pharmaceutiques et les gouvernements pour financer des essais sur le long COVID.
- Mise en place d’incitations financières (subventions, crédits d’impôt, programmes de financement public) pour attirer les entreprises vers ce domaine.
- Utilisation des infrastructures existantes (essais cliniques du NIH, programmes de recherche sur les maladies chroniques) pour faciliter l’intégration des études sur le long COVID.
Un enjeu de santé publique majeur
L’article insiste sur le fait que le long COVID représente un défi sanitaire mondial qui nécessite une réponse coordonnée.
- L’approche la plus prometteuse repose sur une stratégie combinée, incluant la prévention et le traitement de la persistance virale.
- Il est essentiel d’accélérer le développement de biomarqueurs fiables pour détecter la persistance du SARS-CoV-2 et mieux cibler les essais cliniques.
- Des investissements publics et privés sont nécessaires pour soutenir la recherche et garantir l’accès aux futurs traitements.
L’article conclut que la lutte contre le long COVID pourrait servir de modèle pour d’autres maladies post-infectieuses, comme la fatigue chronique ou les syndromes post-viraux, ouvrant ainsi la voie à une meilleure compréhension des maladies persistantes liées aux infections virales.
Conclusion
L’article Targeting the SARS-CoV-2 reservoir in long COVID met en lumière le rôle probable de la persistance virale dans le développement du long COVID et l’urgence d’explorer des stratégies thérapeutiques ciblées.
Les données actuelles suggèrent que chez certains patients, le SARS-CoV-2 peut persister dans des tissus réservoirs pendant des mois, voire des années après l’infection aiguë. Cette présence prolongée du virus pourrait maintenir une inflammation chronique, perturber le système immunitaire et contribuer aux symptômes persistants du long COVID.
Face à cette hypothèse, plusieurs pistes thérapeutiques sont envisagées :
- Les antiviraux pour réduire la charge virale et empêcher la persistance du virus.
- Les anticorps monoclonaux pour neutraliser les protéines virales et éliminer les cellules infectées.
- Les immunothérapies (cytokines, inhibiteurs des points de contrôle immunitaires) pour restaurer une réponse immunitaire efficace contre le virus persistant.
- Les traitements combinés, inspirés des stratégies utilisées contre le VIH et l’hépatite C, pour maximiser l’élimination du réservoir viral.
Cependant, plusieurs défis méthodologiques et scientifiques compliquent la mise en place d’essais cliniques adaptés :
- L’identification fiable des patients présentant une persistance virale, faute de biomarqueurs standardisés.
- La nécessité de traitements plus longs et mieux ciblés sur les tissus réservoirs.
- L’impact des réinfections sur les essais cliniques, rendant l’interprétation des résultats plus complexe.
L’article insiste également sur l’importance de la prévention, en évaluant si des traitements administrés en phase aiguë (antiviraux, vaccination) pourraient réduire le risque de développement d’un long COVID en limitant la formation d’un réservoir viral.
Enfin, le financement et l’implication de l’industrie pharmaceutique restent des obstacles majeurs. L’absence de cadre réglementaire spécifique et de modèles économiques clairs pour ces traitements freine l’investissement privé. L’article plaide pour une mobilisation conjointe des acteurs publics et privés, à l’image de ce qui a été fait pour le VIH, afin d’accélérer la recherche et la mise au point de thérapies efficaces.
En conclusion, la persistance du SARS-CoV-2 représente une piste prometteuse pour comprendre et traiter le long COVID, mais nécessite encore des avancées méthodologiques et un soutien financier accru. Les travaux en cours pourraient également bénéficier à d’autres maladies post-infectieuses, ouvrant ainsi la voie à une meilleure prise en charge des pathologies chroniques liées aux infections virales.
Référence :
Proal, A. D., Aleman, S., Bomsel, M., Brodin, P., Buggert, M., Cherry, S., Chertow, D. S., Davies, H. E., Dupont, C. L., Deeks, S. G., Ely, E. W., Fasano, A., Freire, M., Geng, L. N., Griffin, D. E., Henrich, T. J., Hewitt, S. M., Iwasaki, A., Krumholz, H. M., Locci, M., Marconi, V. C., Mehandru, S., Muller-Trutwin, M., Painter, M. M., Pretorius, E., Price, D. A., Putrino, D., Qian, Y., Roan, N. R., Salmon, D., Tan, G. S., VanElzakker, M. B., Wherry, E. J., Van Weyenbergh, J., Yonker, L. M., & Peluso, M. J. (2025). Targeting the SARS-CoV-2 reservoir in long COVID. The Lancet Infectious Diseases. https://doi.org/10.1016/S1473-3099(24)00769-2
Liste complète des auteurs et leurs affiliations :
- Amy D. Proal, PhD – PolyBio Research Foundation, Medford, MA, USA
- Soo Aleman, MD – Karolinska Institutet & Karolinska University Hospital, Stockholm, Suède
- Morgane Bomsel, PhD – Institut Cochin, Université Paris Cité, CNRS, INSERM, Paris, France
- Petter Brodin, MD – Karolinska Institutet, Stockholm, Suède & Imperial College London, Royaume-Uni
- Marcus Buggert, PhD – Center for Infectious Medicine, Karolinska Institutet, Suède
- Sara Cherry, PhD – Perelman School of Medicine, University of Pennsylvania, USA
- Daniel S. Chertow, MD – Emerging Pathogens Section, Critical Care Medicine Department, NIH Clinical Center, USA
- Helen E. Davies, MD – Department of Respiratory Medicine, University Hospital Llandough, Cardiff, Royaume-Uni
- Christopher L. Dupont, PhD – Division of Genomic Medicine, J. Craig Venter Institute, University of California San Diego, USA
- Steven G. Deeks, MD – Division of HIV, Infectious Diseases, and Global Medicine, University of California, San Francisco, USA
- E. Wes Ely, MD – Critical Illness, Brain Dysfunction, Survivorship Center, Vanderbilt University Medical Center, USA
- Alessio Fasano, MD – Department of Pediatrics & Mucosal Immunology and Biology Research Center, Massachusetts General Hospital, Harvard Medical School, USA
- Marcelo Freire, PhD – Department of Infectious Diseases, J. Craig Venter Institute, USA
- Linda N. Geng, MD – Department of Medicine, Stanford University School of Medicine, USA
- Diane E. Griffin, PhD – W. Harry Feinstone Department of Molecular Microbiology and Immunology, Johns Hopkins Bloomberg School of Public Health, USA
- Timothy J. Henrich, MD – Division of Experimental Medicine, University of California, San Francisco, USA
- Stephen M. Hewitt, MD – Laboratory of Pathology, National Cancer Institute, NIH, USA
- Akiko Iwasaki, PhD – Department of Immunobiology, Yale University School of Medicine, USA; Howard Hughes Medical Institute, USA
- Harlan M. Krumholz, MD – Center for Outcomes Research and Evaluation, Yale New Haven Hospital; Department of Internal Medicine & Health Policy, Yale School of Medicine & Yale School of Public Health, USA
- Michela Locci, PhD – Department of Microbiology, Perelman School of Medicine, University of Pennsylvania, USA
- Vincent C. Marconi, MD – Emory University School of Medicine & Rollins School of Public Health, Atlanta, USA
- Saurabh Mehandru, MD – Precision Immunology Institute, Icahn School of Medicine at Mount Sinai, USA
- Michaela Muller-Trutwin, PhD – Institut Pasteur, Université Paris-Cité, France
- Mark M. Painter, PhD – Institute for Immunology and Immune Health, University of Pennsylvania, USA
- Etheresia Pretorius, PhD – Department of Physiological Sciences, Stellenbosch University, Afrique du Sud
- David A. Price, MD – Division of Infection and Immunity, Cardiff University School of Medicine, Royaume-Uni
- David Putrino, PhD – Department of Rehabilitation and Human Performance, Icahn School of Medicine at Mount Sinai, USA
- Yu Qian, PhD – Department of Informatics, J. Craig Venter Institute, USA
- Nadia R. Roan, PhD – Gladstone Institutes & Department of Urology, University of California, San Francisco, USA
- Dominique Salmon, MD – Department of Infectious Diseases, Institut Fournier, Assistance Publique – Hôpitaux de Paris, France
- Gene S. Tan, PhD – Department of Infectious Diseases, J. Craig Venter Institute, USA
- Michael B. VanElzakker, PhD – Division of Neurotherapeutics, Massachusetts General Hospital, Harvard Medical School, USA
- E. John Wherry, PhD – Institute for Immunology and Immune Health, Perelman School of Medicine, University of Pennsylvania, USA
- Johan Van Weyenbergh, PhD – Laboratory of Clinical and Epidemiological Virology, Rega Institute, KU Leuven, Belgique
- Lael M. Yonker, MD – Department of Pediatrics, Massachusetts General Hospital, Harvard Medical School, USA
- Michael J. Peluso, MD – Division of HIV, Infectious Diseases, and Global Medicine, University of California, San Francisco, USA
Résumé des institutions impliquées :
Cet article résulte d’une collaboration internationale entre des chercheurs issus de plusieurs institutions prestigieuses :
- Instituts de recherche médicale et virologique : Karolinska Institutet (Suède), Institut Pasteur (France), NIH (USA), Institut Cochin (France), Rega Institute (Belgique)
- Universités de premier plan : Harvard Medical School, Yale University, University of Pennsylvania, UCSF, Emory University, Cardiff University
- Centres spécialisés en immunologie et maladies infectieuses : Mount Sinai, Gladstone Institutes, PolyBio Research Foundation, Icahn School of Medicine
Cette diversité institutionnelle reflète l’ampleur de la recherche sur la persistance du SARS-CoV-2 et la volonté de rassembler des expertises variées pour mieux comprendre et traiter le long COVID.


Laisser un commentaire