Résumé : Une étude italienne récente suggère qu’un sous-groupe de patients souffrant de Long COVID présente une signature auto-immune : la présence d’auto-anticorps dirigés contre des récepteurs GPCR (récepteurs couplés aux protéines G), notamment contre le récepteur β2-adrénergique. Ces anticorps augmentent en moyenne chez les LC comparés à des sujets post-COVID asymptomatiques, et leurs niveaux s’associent aux symptômes (fatigue sévère, « brain fog », intolérance à l’effort). Les auteurs proposent que ces auto-anticorps perturbent la régulation neuro-végétative et vasculaire (axe HPA, réflexe vagal anti-inflammatoire), prolongeant l’inflammation et la fatigue chronique. Ils testent même un diagnostic exploratoire basé sur un seuil d’anticorps, mais l’échantillon très restreint (11 LC vs 4 témoins) impose la plus grande prudence. Ce travail ouvre des pistes sur de nouveaux biomarqueurs et traitements (élimination d’auto-anticorps), tout en restant hautement hypothèse-générateur en attendant des études plus larges.
Contexte scientifique
Le Long COVID (LC) est défini comme un syndrome post-infectieux persistant au-delà de trois mois après l’infection aiguë par le SARS-CoV-2. Il se manifeste par un ensemble hétérogène de symptômes handicapants : fatigue chronique intense, troubles cognitifs (« brain fog »), intolérance à l’effort, dysautonomie (palpitations, hypotension), douleurs diffuses, etc. Ces traits clinico-physiopathologiques rappellent souvent l’encéphalomyélite myalgique / syndrome de fatigue chronique (ME/CFS). Selon Camici et al., la prévalence du Long COVID est très élevée à l’échelle mondiale et son impact sociétal est majeur (baisse de qualité de vie, coûts de santé, incapacités professionnelles), d’où l’urgence de mieux comprendre sa cause. À ce jour, il n’existe aucun biomarqueur diagnostique validé ni traitement spécifique approuvé.
Hypothèse auto-immune. Des indices récents évoquent un rôle auto-immun dans le LC. Par exemple, des études ont montré que le transfert d’IgG de patients LC à des souris peut reproduire certains symptômes, suggérant que des anticorps pathologiques participeraient à la maladie[1]. En particulier, l’attention se porte sur les auto-anticorps contre les GPCR – une vaste famille de récepteurs membranaires. Les GPCR (pour récepteurs couplés aux protéines G) régulent la transmission nerveuse, le tonus vasculaire et la modulation immunitaire. On suspecte que des anticorps anti-GPCR (notamment β1, β2-adrénergiques et muscariniques M1–M4) pourraient expliquer la dysrégulation autonome et inflammatoire du LC[1]. Ce paradigme est appuyé par l’observation d’améliorations cliniques après élimination d’anticorps (immunoadsorption) dans certains patients LC[1]. L’étude de Camici et al. se fonde sur cette hypothèse : elle explore le profil des auto-anticorps anti-GPCR chez des patients LC afin de déceler une éventuelle signature auto-immune et d’évaluer ses corrélations avec les symptômes.
Objectifs de l’étude
L’étude de Camici et al. (2026) est une analyse exploratoire visant à :
- Comparer la prévalence et les niveaux d’auto-anticorps anti-GPCR chez des patients Long COVID sévères (≥5 symptômes persistants) versus des sujets post-COVID asymptomatiques (APC).
- Évaluer les corrélations entre ces auto-anticorps et l’intensité des symptômes cliniques, en particulier la fatigue (évaluée par le score FAS).
- Examiner l’axe hypothalamo-hypophyso-surrénalien (axe HPA) : en mesurant le cortisol matinal et l’ACTH pour voir s’il est altéré chez les LC.
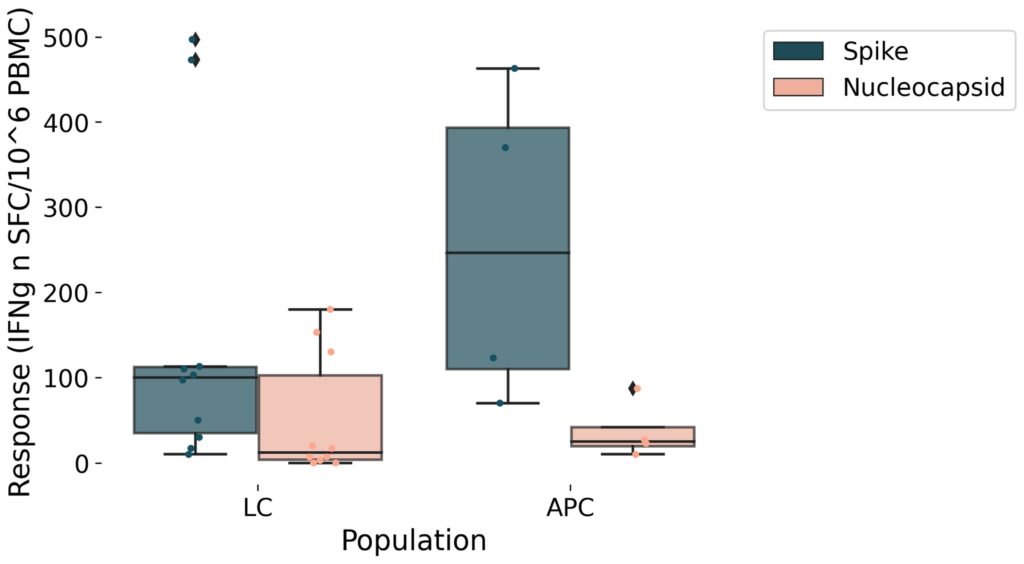
- Mesurer la réponse immunitaire cellulaire spécifique au SARS-CoV-2 : via un test ELISpot détectant les lymphocytes T qui produisent de l’IFN-γ en présence d’antigènes Spike ou N.
- Proposer un outil diagnostique exploratoire : déterminer des seuils d’anticorps basés sur les données des témoins APC pour « dépister » le Long COVID par un test d’anticorps (méthode statistique du seuil au 95e percentile).
Méthodologie simplifiée
Les auteurs ont mené une étude cas-témoins monocentrique, prospective (hôpital Spallanzani, Rome). Sur une cohorte initiale de 104 patients post-COVID, ils ont sélectionné un sous-groupe de 15 participants :
– LC (Long COVID sévère) : 11 patients présentant ≥5 symptômes persistants invalidants depuis >3 mois (fatigue, problèmes cognitifs, palpitations, etc.).
– APC (Asymptomatiques Post-COVID) : 4 patients infectés mais totalement remis, sans symptômes persistants.
Tous avaient eu un diagnostic de COVID confirmé par PCR, et aucun facteur confondant (par ex. traitement corticoïde ou maladie auto-immune active).
Tests immunologiques et endocriniens :
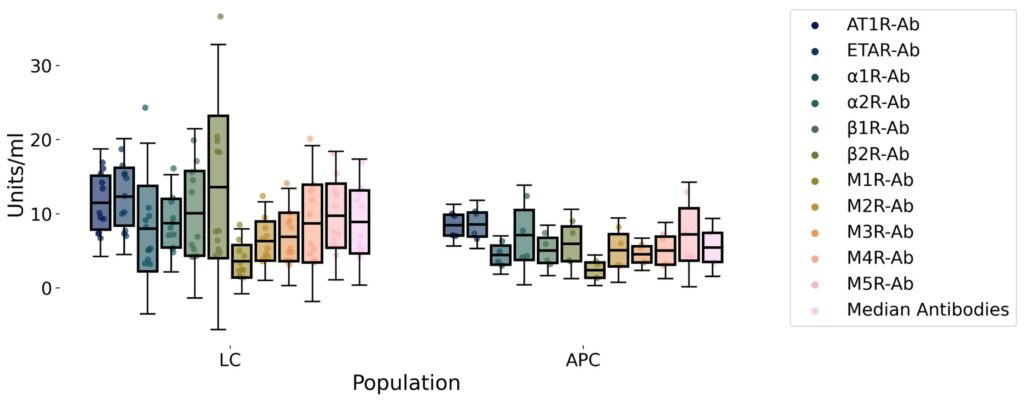
– Auto-anticorps anti-GPCR : les chercheurs ont dosé par ELISA (test immunologique) un panel d’anticorps dirigés contre 11 récepteurs GPCR. Ce sont : les récepteurs de l’angiotensine II (AT1R), de l’endothéline A (ETAR), les récepteurs α1 et α2-adrénergiques, les récepteurs β1 et β2-adrénergiques, et les récepteurs muscariniques M1, M2, M3, M4, M5. Ces tests ELISA (enzyme-linked immunosorbent assay) mesurent quantitativement les titres d’anticorps dans le sérum. (Tableau ci-dessous).
– Fatigue : évaluée par le score FAS (Fatigue Assessment Scale, 10 questions, note 0–50). Un score ≥22 signale de la fatigue, ≥35 une fatigue sévère.
– Axe HPA : dosage du cortisol sanguin à 8h du matin et de l’ACTH pour apprécier la fonction corticosurrénalienne (axe hypothalamo-hypophyso-surrénalien).
– Immunité cellulaire : test ELISpot mesurant la réponse T (IFN-γ) après stimulation ex vivo des lymphocytes T avec des peptides du Spike (S) ou du N de SARS-CoV-2. On compte les « spots » formés par des lymphocytes sécrétant de l’IFN-γ.
Définitions de termes clés (intégrées) : GPCR (récepteur couplé aux protéines G), famille de récepteurs impliqués dans la transmission neuro-végétative et la régulation vasculaire ; auto-anticorps, anticorps contre des cibles du « soi » ; ELISA, test immunologique de laboratoire quantifiant un anticorps ; ELISpot, test cellulaire quantifiant les lymphocytes T spécifiques via l’interféron gamma ; axe HPA, axe hormonal corticotrope gérant la réponse au stress (hypothalamus → hypophyse → cortisol).
Principaux résultats
Les résultats se déclinent en différences cliniques, biochimiques et corrélations :
- Données cliniques : Les deux groupes étaient majoritairement des femmes. L’âge moyen tendait à être plus jeune chez les LC (49 ans) que les APC (61 ans), mais cette différence n’était pas statistiquement significative. Les LC avaient significativement moins de comorbidités (p=0.03) et avaient reçu moins de doses de vaccin contre la COVID (p=0.03) que les APC. Surtout, la fatigue mesurée par le FAS était beaucoup plus élevée chez les LC : score moyen 33 versus 12 (p=0.005) (score « physique » 17.5 vs 7, « mental » 15.7 vs 5.2, tous p=0.005). Cela confirme que les LC du groupe étaient véritablement très fatigués et symptomatiques.
- Auto-anticorps anti-GPCR : Globalement, les niveaux médians d’auto-anticorps testés étaient plus élevés chez les LC que chez les APC (valeur médiane totale ~8.4 vs 5.5 unités, p=0.28). Ce n’est pas significatif statistiquement (p>0.05), mais la tendance était constante pour tous les anticorps mesurés. Notamment, l’anticorps anti-β2-adrénergique présentait la plus grande différence de titre brut entre LC et APC (voir Fig.1/Tableau 2 du papier). En résumé, les LC avaient une « signature » de tous petits surcroîts d’auto-anticorps ciblant plusieurs récepteurs β et muscariniques, sans qu’un anticorps seul ne soit nettement hors norme individuellement (p-values non significatives).
- Cortisol matinal : Les sujets LC avaient un cortisol sanguin significativement plus bas (13 µg/dL en moyenne) que les APC (17.7 µg/dL, p=0.01). Cela suggère une possible dysrégulation de l’axe HPA (cortisol insuffisant) chez les LC. L’ACTH était légèrement plus bas chez LC (14 vs 22 pg/mL), mais non significatif (p=0.11).
- Réponse T spécifique (ELISpot) : Les APC asymptomatiques montraient une réponse plus forte des lymphocytes T au SARS-CoV-2, surtout vis-à-vis de l’antigène Spike. Chez les LC, le nombre de spots IFN-γ était plus faible (tendance), ce qui laisse penser que les LC peuvent avoir une réponse antivirale cellulaire affaiblie. Cela pourrait suggérer une élimination incomplète du virus ou une persistance antigénique chez les LC.
- Analyse de corrélation (heatmap) : Les auteurs ont construit une matrice de corrélations (Figure 3 du papier) pour regrouper les paramètres. Ils ont observé deux « blocs » principaux :
- Cluster « auto-immun » : Les anticorps anti-GPCR (β1, β2, α1, α2, muscariniques M2–M4, AT1R, ETAR) étaient fortement corrélés entre eux (hausse conjointe). Ce groupe d’anticorps formait une signature unie qui s’associait positivement aux symptômes : fatigue FAS élevée, palpitations, hypotension orthostatique, intolérance à l’effort, troubles cognitifs, etc. Autrement dit, plus les anticorps anti-GPCR étaient élevés, plus le patient rapportait de symptômes sévères.
- Cluster « protecteur » : À l’inverse, certains facteurs (âge plus avancé, cortisol plus élevé, nombre de vaccins reçus) étaient corrélés négativement avec le cluster auto-immun et les symptômes. En pratique, les LC plus jeunes, moins vaccinés et avec un cortisol bas avaient plus d’auto-anticorps et de fatigue, alors que les plus âgés/vaccinés/cortisol plus élevé présentaient moins de ces marqueurs.
Cette matrice confirme l’existence d’une « signature auto-immune » cohérente : un même axe regroupe anticorps et fatigue, en miroir inverse des facteurs (âge, vaccins, HPA). Elle appuie l’hypothèse d’un lien mécanistique entre auto-anticorps anti-GPCR et intensité du Long COVID.
Tableau 1. Caractéristiques cliniques et biologiques des patients Long COVID (LC) comparés aux témoins post-COVID asymptomatiques (APC). Les valeurs sont moyennes ± écart-type. (Données issues de Camici et al., 2026.)
| Variable | Long COVID (LC) | APC asymptomatique |
|---|---|---|
| Âge (ans, moyenne ± écart) | 49 ± 15 | 61 ± 17 |
| Score FAS (fatigue) | 33 ± 9.3 (sur 50) | 12 ± 2.1 |
| Cortisol matinal (µg/dL) | 13 ± 3 | 17.7 ± 2 |
| Nombre de vaccins reçus | 2.6 ± 0.8 | 3.7 ± 0.4 |
(FAS : Fatigue Assessment Scale; pas de signification statistique sur l’âge ici, mais p=0.005 pour la différence de FAS et p=0.01 pour le cortisol.)
Auto-anticorps GPCR mesurés. Les auteurs ont dosé, par ELISA, les anticorps suivants : anti-AT1R, anti-ETAR, anti-α1R, anti-α2R, anti-β1R, anti-β2R, anti-M1R, anti-M2R, anti-M3R, anti-M4R, anti-M5R. Le tableau ci-dessous résume ces anticorps et le récepteur ciblé :
| Auto-anticorps | Cible GPCR (récepteur) | Rôle physiologique (résumé) |
|---|---|---|
| AT1R-Ab | Récepteur de l’angiotensine II type 1 (AT1R) | Régule la pression artérielle (vasoconstriction). |
| ETAR-Ab | Récepteur A de l’endothéline (ETAR) | Vasoconstriction et tonus vasculaire. |
| α1R-Ab | Récepteur α1-adrénergique | Vasoconstriction artérielle (augmente la TA). |
| α2R-Ab | Récepteur α2-adrénergique | Modulation du tonus sympathique (feedback). |
| β1R-Ab | Récepteur β1-adrénergique | Cœur : augmente rythme cardiaque et contractilité. |
| β2R-Ab | Récepteur β2-adrénergique | Vasodilatation, bronchodilatation et immunomodulation. |
| M1R-Ab | Récepteur muscarinique M1 | Fonctions cognitives (système nerveux central). |
| M2R-Ab | Récepteur muscarinique M2 | Cœur : ralentit la fréquence cardiaque. |
| M3R-Ab | Récepteur muscarinique M3 | Muscles lisses et glandes (contraction, sécrétion). |
| M4R-Ab | Récepteur muscarinique M4 | SNC (modulation dopaminergique). |
| M5R-Ab | Récepteur muscarinique M5 | SNC (rôle moins clair, modulateur dopaminergique). |
Interprétation physiopathologique proposée
Camici et al. proposent que ces auto-anticorps anti-GPCR soient plus qu’un simple marqueur : ils pourraient participer directement aux symptômes du Long COVID. En particulier, les anti-β2-adrénergiques jouent un rôle clé dans leur scénario.
Mécanisme suggéré : En conditions normales, le récepteur β2-adrénergique (β2R) a un effet apaisant sur le système immunitaire et vasculaire : son activation réduit la production de cytokines inflammatoires (ex. TNFα) et stimule la production d’IL-10 anti-inflammatoire. Il favorise aussi la dilatation des vaisseaux et améliore l’apport sanguin musculaire. Si des auto-anticorps se fixent sur le β2R, ils peuvent bloquer ou fausser son signal (effet antagoniste stérique). Autrement dit, c’est comme si on avait un « faux interrupteur » sur ce récepteur : la réponse naturelle au stress/inflammation est inhibée. Le résultat serait une inflammation chronique non maîtrisée, une moins bonne perfusion musculaire (expliquant la fatigue à l’effort) et un déséquilibre neuro-végétatif.
On peut schématiser simplement ce modèle (auto-anticorps → dysfonction GPCR → inflammation/symptômes) :
flowchart LR
A[Production d’auto-anticorps anti-GPCR] –> B[Dysfonctionnement des récepteurs β2-adrénergiques]
B –> C[Activation chronique de l’inflammation et dysautonomie]
C –> D[Symptômes LC (fatigue, intolérance à l’effort, « brain fog », etc.)]
Dans cette analogie, imaginez un thermostat (le récepteur β2R) censé réguler la température interne (inflammation). Si quelqu’un sabote le thermostat (les anticorps), la pièce surchauffe. Les symptômes observés chez les patients LC (fatigue intenses, troubles cognitifs flous, palpitations) collent à cette image. Cette explication est cohérente avec des données antérieures : des anticorps anti-β2 ont été impliqués dans d’autres contextes auto-immuns, et leur neutralisation chez la souris augmente l’inflammation.
Par ailleurs, le phénomène corrélationnel noté – plus d’anticorps chez les sujets jeunes et non vaccinés – suggère que la vaccination ou l’âge avancé confèrent un effet protecteur, peut-être via une meilleure élimination virale et une modulation du système immunitaire. Les auteurs avancent aussi que la faible réponse T antivirale chez les LC pourrait indiquer des réservoirs viraux persistants, maintenus par une immunité affaiblie.
Limites de l’étude et appel à la prudence
Camici et al. insistent sur le caractère exploratoire et sur les limites majeures de leur travail :
- Échantillon très restreint (n=15) : uniquement 11 patients LC sévères et 4 contrôles APC. Cette taille minime limite la puissance statistique et la généralisation.
- Sélection non représentative : seuls les LC les plus sévères (≥5 symptômes) ont été inclus ; pas de groupe LC modéré ni de groupe contrôle sain pour cadrer les valeurs « normales » d’anticorps.
- Tests d’anticorps quantitatifs seulement : les dosages par ELISA mesurent la quantité d’anticorps, mais pas leur activité fonctionnelle (agoniste vs antagoniste). On ne sait pas si ces anticorps bloquent réellement le récepteur ou sont juste des marqueurs.
- Étude transversale : les mesures sont à un seul moment. On ne sait pas ce qui précède quoi (cause à effet) ni si les anticorps évoluent dans le temps.
- Différences démographiques : bien que non significative, la différence d’âge (plus jeune chez les LC) pourrait biaiser les comparaisons (facteur confondant).
- Exploration sans validation : la proposition de diagnostic par seuil d’anticorps (coupe au 95e percentile des témoins) est purement théorique ici – elle a identifié 5/11 LC sans faux positif, mais sans validation indépendante ni précisions sur sensibilité/spécificité.
En résumé, ces données sont intéressantes mais très préliminaires. Les auteurs demandent explicitement la plus grande circonspection. La corrélation observée ne prouve pas la causalité : seuls des tests fonctionnels et de plus large échelle pourront confirmer que ces anticorps provoquent bien les symptômes (ou si ce sont des épiphénomènes).
Implications cliniques et perspectives
Malgré tout, cette étude soulève plusieurs pistes :
- Biomarqueurs potentiels : Si ces résultats se confirment, on pourrait imaginer un test sanguin d’auto-anticorps anti-GPCR pour aider au diagnostic du Long COVID (actuellement clinique) ou pour identifier les patients à profil immunitaire particulier. Les auteurs suggèrent par exemple un algorithme simple : si au moins un anticorps dépasse un certain seuil, classer le patient LC (à étudier en grand).
- Stratégies thérapeutiques ciblées : Chez le sous-groupe LC avec auto-anticorps élevés, des traitements immunomodulateurs pourraient être étudiés. Des procédés d’immunoadsorption (élimination des IgG du sang) ou d’immunoglobulines intraveineuses (IgIV) sont déjà en essai pour LC. De même, des inhibiteurs du mTOR (comme la rapamycine) ont montré des bénéfices préliminaires chez des LC avec anticorps anti-β2 élevés. Ces approches visent à rétablir l’équilibre immunitaire.
- Rôle protecteur de la vaccination : Les corrélations observées confirment des données déjà publiées : la vaccination COVID réduit le risque de développer un Long COVID. Dans cette étude, les sujets APC (complètement vaccinés) avaient moins d’anticorps auto-immunes et de fatigue, suggérant que l’immunité vaccinale aide à éviter la cascade auto-immune post-infectieuse.
- Recherche urgente : Il est impératif de mener des études plus vastes, idéalement multicentriques et longitudinales, pour tester ces hypothèses. Un travail de consortium international devrait évaluer ces anticorps dans un grand nombre de LC (de sévérité variée) et de sujets contrôles (y compris sains). Il faudra coupler cela à des études fonctionnelles : par exemple, vérifier in vitro si les IgG de LC neutralisent réellement les récepteurs β2 ou modifient la réponse des cellules immunitaires.
Conclusion
En conclusion, Camici et al. apportent un éclairage pertinent sur le possible rôle des auto-anticorps GPCR dans le Long COVID. Ils montrent l’existence d’une signature auto-immune associée à la fatigue et aux troubles dysautonomiques, suggérant que l’immunité du soi pourrait dysréguler la physiologie des patients LC. Cette étude, riche en idées, est cependant préliminaire et n’avalise pas encore le concept : les observations doivent être confirmées avant d’en tirer des applications cliniques. Il faut garder un esprit critique et scientifique : aucune panacée n’est établie, et chaque nouvelle piste nécessite des preuves rigoureuses. Néanmoins, les résultats soutiennent l’idée qu’un sous-groupe de Long COVID pourrait bénéficier de traitements immunologiques ciblés. En attendant des données plus solides, le message est clair : restons vigilants face aux résultats trop rapides, et continuons la recherche pour percer ce mystère du Long COVID.

